JSBB: Volume 1, Issue 3, August 2022
Concept article - STRUCTURE & FUNCTION ARTICLES
Protein Structure and Function in Dormant state and Protection from Death.
البنية-الفراغية للبروتين ووظيفته ودوره في حالة السّبات والحماية من الموت.
RACHEDI Abdelkrim
Faculty of Sciences, Department of Agriculture and nutrition, University of Saida - Dr Tahar Moulay, 20100 Saida, Algeria.
RACHEDI Abdelkrim - E. mail: abdelkrim.rachedi@univ-saida.dz
Published: 01 December 2022
The first 3D structure of a Secretory Abundant Heat Protein extracted from the microscopic animal Tardigrade, Ramazzottius varieornatus, was recorded in the Protein Databank resource on 26 July 2017.
A microscopic tardigrade in the first and second figures (comparison for clarity of size).
This study is considered one of the most accurate studies at the atomic and molecular level in an attempt to understand how this animal can survive for long periods of time in a state of near-total dehydration, where its body loses almost all of its water in a biological phenomenon that can be called biotic dehydration or anhydrobiosis.
أول تركيب ثلاثي الأبعاد لبروتين Secretory Abundant Heat Protein مستخلص من الحيوان المجهري "بطيء-الخطى" Tardigrade أو Ramazzottius varieornatus تم تسجيله في قاعدة البيانات للتراكيب الفراغية في 26 جويلية 2017.
الحيوان المجهري "بطيء-الخطى" Tardigrade في الصورة الأولى و الصورة الثانية (مقارنة لتوضوح الحجم).
هذه الدراسة تعتبر من أدق الدراسات على المستوى الذّري والجزيئي في محاولة لفهم كيف يتمكن هذا الحيوان من البقاء على الحياة لمدد طويلة في حالة الجفاف الشبه التام حيث يفقد جسمه كل ماءه تقريبا في ظاهرة بيولوجية يمكن تسميتها بـ الجفاف-الحيوي أو َAnhydrobiosis
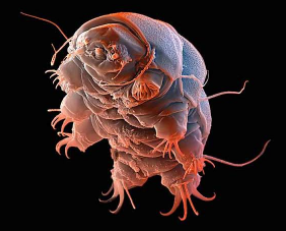
Figure 1. Tardigrade, Ramazzottius Varieornatus
11th International Symposium on Tardigrada - Conference Guide, see: http://www.tardigrada.net/newsletter/images/symposia/11_Booklet.pdf
11th International Symposium on Tardigrada - Conference Guide, see: http://www.tardigrada.net/newsletter/images/symposia/11_Booklet.pdf

Figure 2. Size comparison between a Tardigrade, Ramazzottius Varieornatus 5×10−5m compared
to a dust mite the size of 2×10−4m.
to a dust mite the size of 2×10−4m.
More precisely, the question is how does the biology of this animal protects cells from death and maintain a very low level of metabolism that can keep it alive until conditions change and water is present in its environment.
The images of the structures below are for one of these proteins whose three-dimensional structure contributes to providing high resistance against dehydration in of the vital organs in which this protein is present.
This protein is composed of a β-barrel structural motif, figures 3 and 4. This motif is spatially similar to the structural pattern characteristic of fatty acid-binding proteins.
التساؤل بشكل أدق، كيف تحمي عضوية هذا الحيوان الخلايا من الموت وتُـبْقِى على مستوى ضئيل جدا من الميتابوليزم الحيوبي الذي يبقيه حيّا إلى أن تتغير الظروف ويتواجد الماء في وسطه المعيشي.
صورة التركيب الفراغي الموجودة أدناه هي لأحد هذه البروتينات التي تساهم بتركيبها ثلاثي الأبعاد في توفير مقاومة عالية ضد الجفاف لدى الأعضاء الحيوية التي يوجد بها هذا البروتين.
هذا البروتين المتشكل من نمط_برميل_بِيتَا β-barrel structure، الصورة الثالثة و الرابعة، و الشبيه فراغيا بالنّمط التركيبي المُمَيِّز للبروتينات الرابطة للأحماض الدهنية Fatty acid-binding proteins.
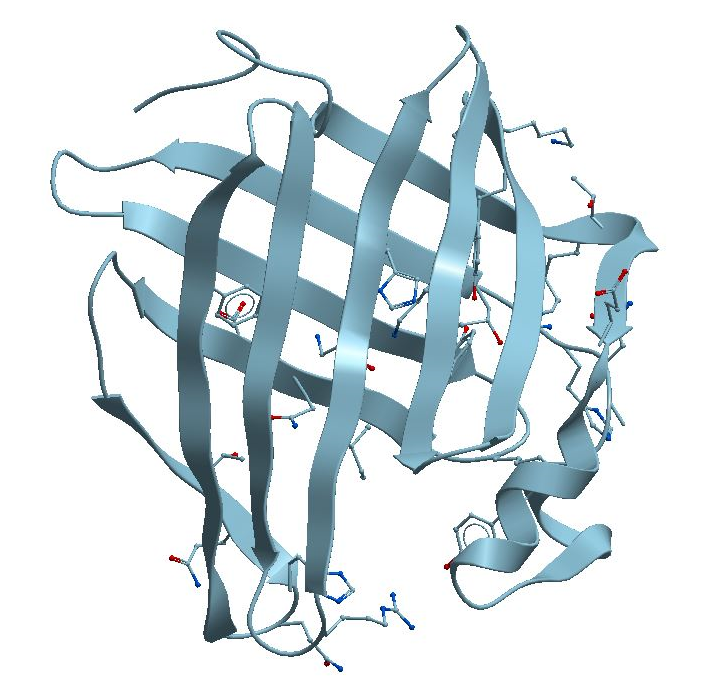
Figure 3. The structure of Dimeric form of the Secretory Abundant Heat-Protein
(Lipid Transport) from a Tardigrade microscopic animal. See:
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xna
(Lipid Transport) from a Tardigrade microscopic animal. See:
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xna
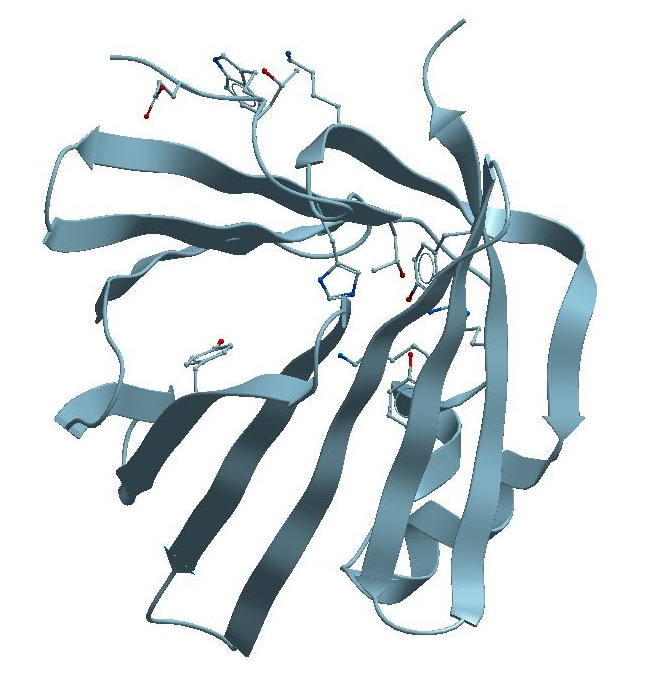
Figure 4. The structure of Monomeric form of the Secretory Abundant Heat-Protein
(Lipid Transport) from a Tardigrade microscopic animal. See:
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xn9
(Lipid Transport) from a Tardigrade microscopic animal. See:
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xn9
According to the authors of this structural study, see link below, a group of hydrophilic amino acids residues form distinct networks of hydrogen bonds that give this protein greater resistance against dehydration.
It seems that the structural-functional properties of this protein, which is widely distributed in this microscopic animal, contribute to the protection of extracellular structures and/or secretory organelles, which leads to the survival of the animal even in conditions of severe dehydration.
The 3D-structures of this protein can be explored using the SSFS⭕ application, Figure 5, which is available on the "Bioinformatics-server" website by Department of Biology, Faculty of Science - Saida University; on the links below:
حسب القائمين بالدراسة التركيبية هذه، أنظر الرابط أدناه، فإن مجموعة من الأحماض الأمينية المحبة للماء hydrophilic residues تشكل فيما بينها شبكات متميزة من الروابط الهيدروجينية و التي تُكسِب هذا البروتين تَحَمُّلا أكبر ضد الجفاف.
يبدو أن الخواص التركيبية_الوظيفية لهذا البروتين، المنتشر بكثرة في هذا الحيوان المجهري، تساهم في حماية التراكيب الخارج خلوية و/أو العضيات الإفرازية .. ما يؤدي إلى بقاء الحيوان حيا حتى في ظروف الجفاف الشديد.
يمكن استكشاف التراكيب الفراغية لهذا البروتين باستخدام التطبيق SSFS⭕، الصورة الخامسة، المتوفر على موقع " تطبيقات في المعلوماتية_الحيوية Bioinformatics-sever" - قسم البيولوجيا، كلية العلوم - جامعة سعيدة؛ على الروابط أدناه.
🖝 Structural Insights Into A Secretory Abundant Heat-Protein From An Anhydrobiotic Tardigrade, Ramazzottius Varieornatus.
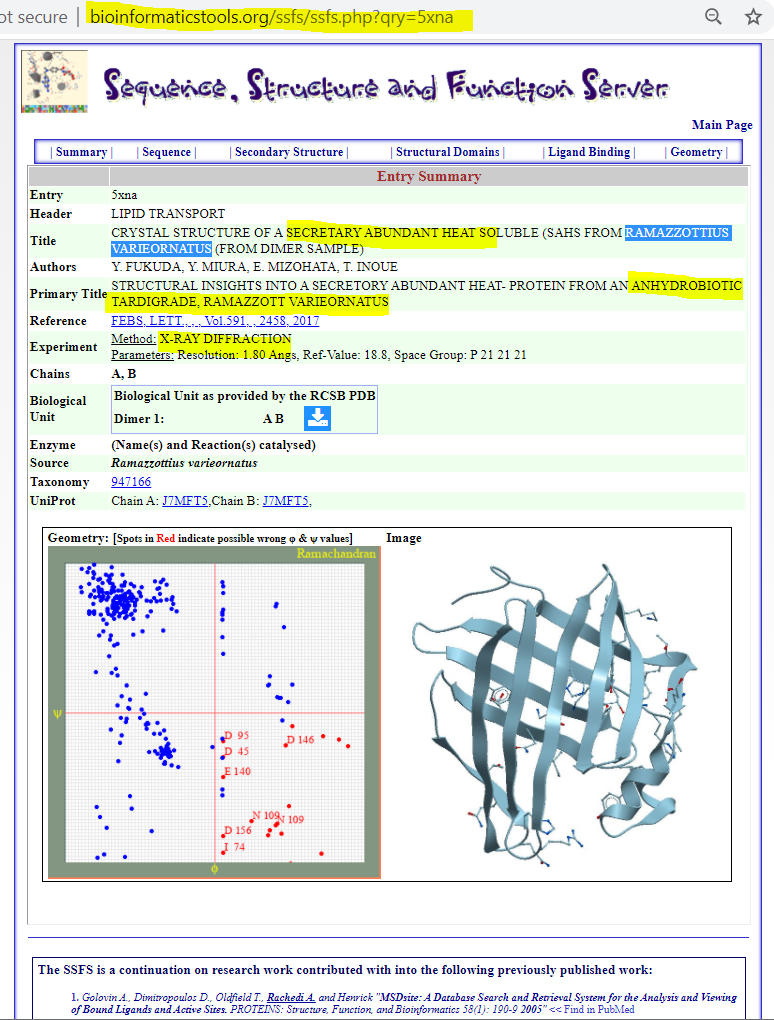
Figure 5. Structural Insights Into A Secretory Abundant Heat-Protein
from An Anhydrobiotic Tardigrade, Ramazzottius Varieornatus Data provided by the SSFS tool
extracted from the Protien Databank
for the PDB id: 5XNA, see: https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xna
from An Anhydrobiotic Tardigrade, Ramazzottius Varieornatus Data provided by the SSFS tool
extracted from the Protien Databank
for the PDB id: 5XNA, see: https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=5xna
It's also possible to investigate the Heat-Protein's structure by using the PDB archive in Europe and USA, the links below:
كما يمكن استكشاف هذا التركيب على موقع قاعدة بيانات التراكيب الفراغية الأمريكي و الأوروبي باستخدام الرمز الخاص بهذا البروتين 5XNA كما في الروابط التالية:
In relation to the family of Tardigrada, explore the following conference document:
فيما يتعلق بعائلة Tardigrada، استكشف وثيقة المؤتمر التالية:
⭕ SSFS: Sequence, Structure and Function Server by the Structural Biology & Bioinformatics Groups, Biology Dept, Faculty of Science, University of Saida, Algeria
نظام: التركيب الأولي، التركيب الفراغي و الوظيفة البيولوجية ، فريق البيولوجيا ثلاثية
الأبعاد و المعلوماتية الحيوية، قسم البيولوجيا، كلية العلوم، جامعة سعيدة، الجزائر