The β-taco fold & Bacterial Adherence Mechanism to Target Cells.
طيّة-بيتا-تاكو الورقية وآلية التساق البكتريا بخلايا الهدف.
Abdelkrim RACHEDI
Laboratory of Biotoxicology, Pharmacognosy and biological valorisation of plants, Faculty of Sciences, Department of Biology, University of Saida - Dr Tahar Moulay, 20100 Saida, Algeria.
📧 E. mail: abdelkrim.rachedi@univ-saida.dz
Published: 24 November 2022
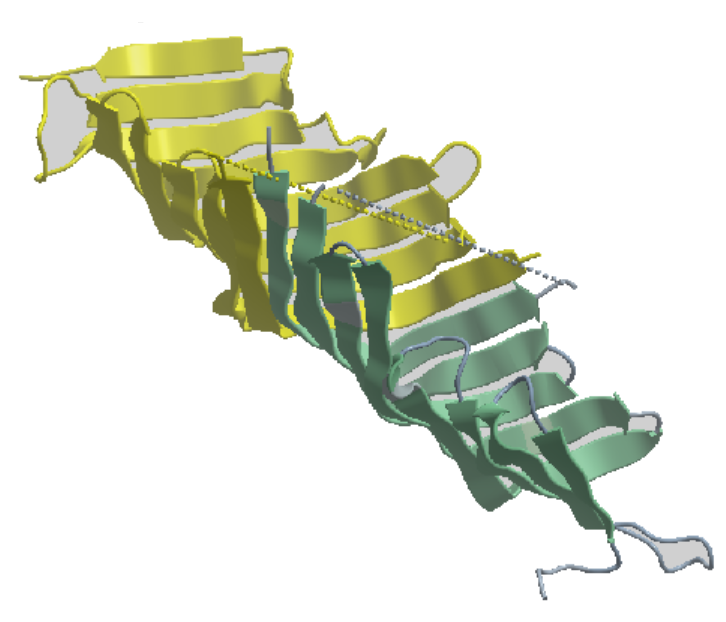
Among the 3D-structural motifs that inters in the make up of the structure of proteins, a relatively new motif known as β-taco fold, Figure 1, named after the shape of the Taco sandwich. See the paper mentioned in the link below.
The protein subject of the this discovery is TamB part of the complex system TAM that some disease causing bacteria in protein toxin secretions used to adhere onto host targets.
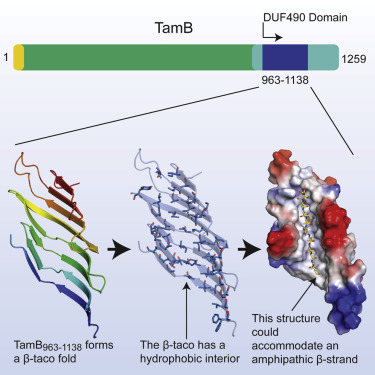
The paper, below, discusses the ways in which the β-taco module performs its biological function starting from the hollow shape that seems suitable for transporting through small proteins to the fact that this shape is mostly lined with hydrophobic amino acids, which may help "slipping" the transporting proteins which are also of overall hydrophobic nature.
من بين الأنماط التركيبية ثلاثية_الأبعاد الداخلة في التراكيب الفراغي للبروتينات، هناك تركيب حديث الإكتشاف نسبيا يسمي بـ ' طيّة-بيتا-تاكو الورقية ' أو β-taco fold، أنظر الصورة 1، وهذا لشبهها بشطيرة التاكو Taco sandwich. أنظر ورقة البحث المشار إليها في الرابط أدناه.
هذا البروتين البكتيري يدعى بـ TamB وهو جزء من النظام المعقد TAM الذي تستخدمه البكتريا الممرضة في إفراز بروتينات الإلتساق على الأهداف وإفراز سموم بروتينية وعوامل ممرضة.
يناقش البحث المنشور أوجه عديدة لعلاقة التركيب الفراغي لـهذه الطيّة β-taco بوظيفته البيولوجية بدءا من الشكل المجوف الذي يبدو مناسبا لنقل البروتينات عبره إلى كون هذا الشكل مُبطن في معظمه بأحماض أمينية كارهة للماء الأمر الذي يبدو أنه يساعد على "انزلاق" البروينات التي تمر فيه والتي هي بدورها ذات طبيعة كارهة للماء.
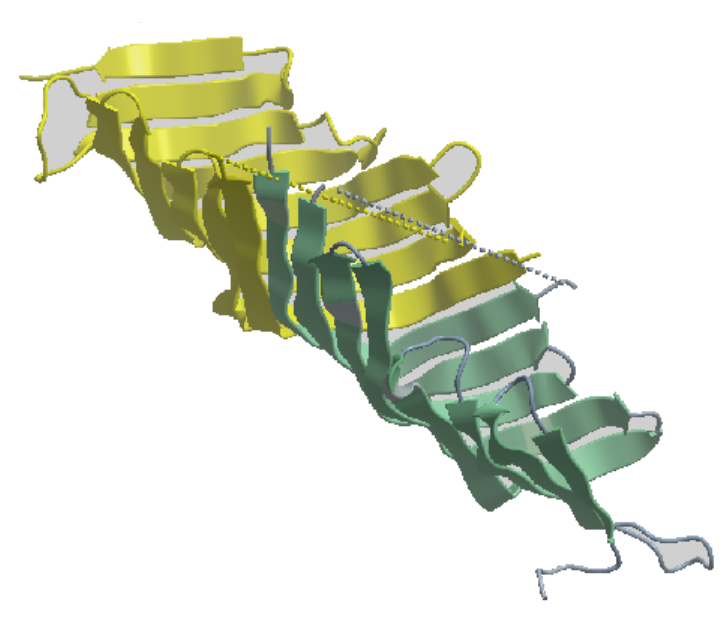
Figure 1. Taco shaped 3D-structure Fold (β-Taco) taken up by the protein TAMB residue region 963-1138 from the E. coli bacterium.
For more details, follow the paper's link below:
للمزيد يمكن مطالعة البحث المنشور حول الموضوع؛ أنقر على الرابط التالي:
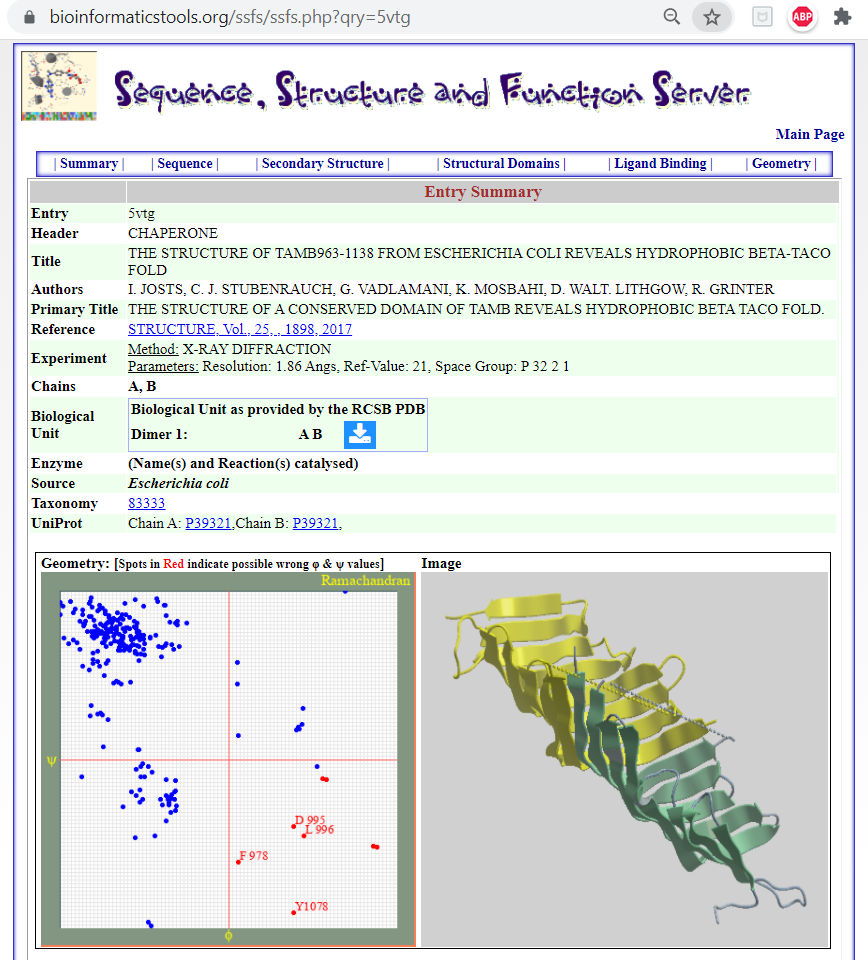
Its possible to explore the structure and function of the TamB protein using the SSFS⭕ tool, PDB id 5VTG, available on Bioinformatics-server website, Department of Biology, University of Saida, Algeria; the link below:
يمكن استكشاف التركيب الفراغي لهذا البروتين، TamB، احامل للرمز 5VTG، ووظائفه البيولوجية باستخدام نظام SSFS⭕ المتوفر على موقع_الواب " أنظمة في المعلوماتية-الحيوية أو Bioinformatics Tools"، قسم البيولوجيا، جامعة سعيدة وذلك بالنقر على الرابط التالي:
🖝 The Structure Of Tamb963-1138 From Escherichia Coli Reveals Hydrophobic Beta-Taco Fold
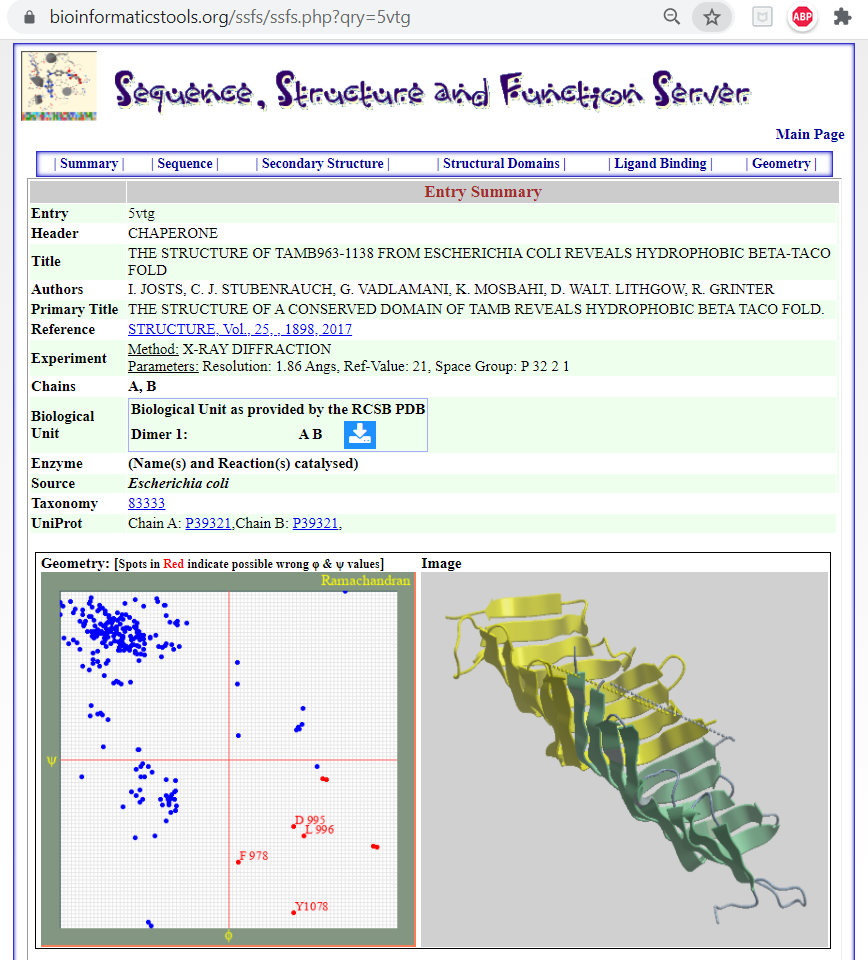
Figure 2. The structural fold β-taco of a Chaperone protein example.
Data provided by the SSFS tool extracted from the Protien Databank for the PDB id: 5VTG.
Data provided by the SSFS tool extracted from the Protien Databank for the PDB id: 5VTG.
It's also possible to investigate the TamB's structure by using the PDB archive in Europe and USA, the links below:
كما يمكن استكشاف هذا التركيب على موقع قاعدة بيانات التراكيب الفراغية الأمريكي و الأوروبي باستخدام الرمز الخاص بهذا البروتين 5VTG كما في الروابط التالية:
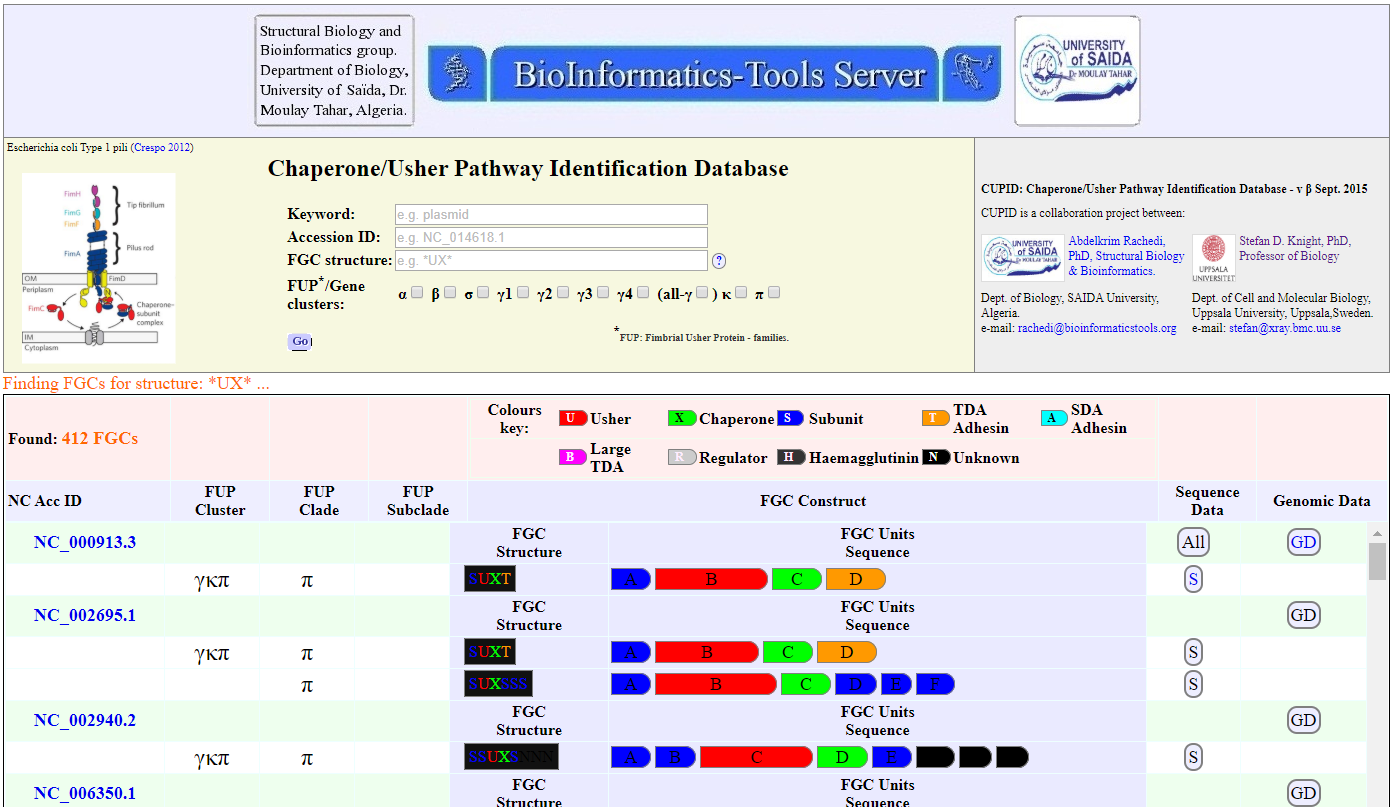
For more information about proteins involved as bacterial factors for adherence to host's tissue targets during infections, use the CUPID🔶 search tool, Figure 4. As an example, follow the link below for data on the Chaperone-Usher Fimbriae types of Escherichia coli SMS-3-5, Figure 5 :
للحصول على المزيد من المعرفة حول البروتينات الداخلة في آليات الإلتساق البكتيري والعوامل الممرضة على الأهداف والأنسجة، استكشف نظام البحث CUPID🔶، الصورة 4.
تابع الرابط التالي للحصول على بيانات حول أنواع Chaperone-Usher Fimbriae لـ بكتيرة Escherichia coli SMS-3-5 ، الصورة 5:
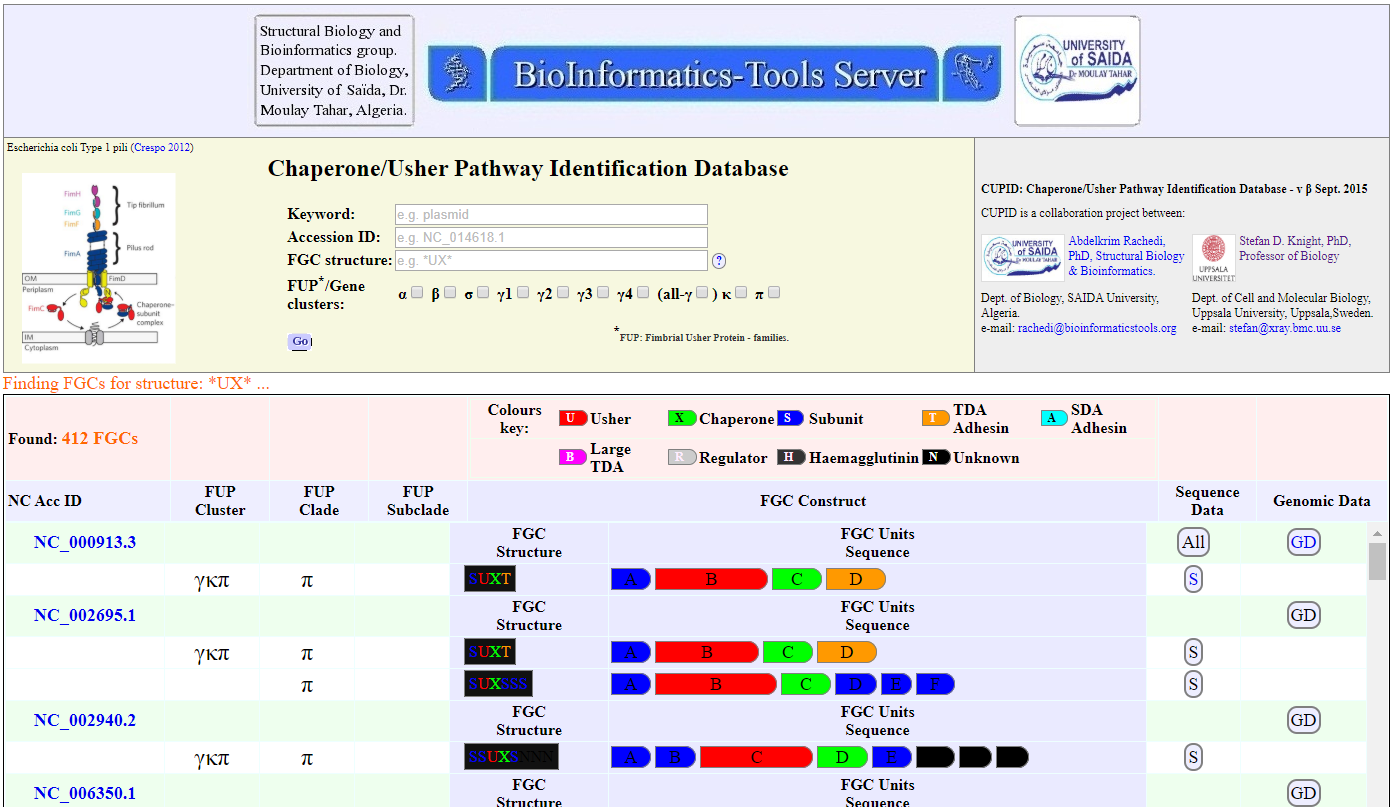
Figure 4. The web-interface of CUPID: Chaperone/Usher Pathway Identification Database.

Figure 5. Example about the detailed data for the Chaperone-Usher Fimbriae types of the Escherichia coli SMS-3-5.
Once the page is loaded, click on the different parts in the graphics for more data
Once the page is loaded, click on the different parts in the graphics for more data
🔶 CUPID: Chaperone/Usher Pathway Identification Database by the Structural Biology & Bioinformatics Groups, Biology Dept, Faculty of Science, University of Saida, Algeria
⭕ SSFS: Sequence, Structure and Function Server by the Structural Biology & Bioinformatics Groups, Biology Dept, Faculty of Science, University of Saida, Algeria
نظام: التركيب الأولي، التركيب الفراغي و الوظيفة البيولوجية ، فريق البيولوجيا ثلاثية
الأبعاد و المعلوماتية الحيوية، قسم البيولوجيا، كلية العلوم، جامعة سعيدة، الجزائر