JSBB: Volume 1, Issue 3, October 2022 - STRUCTURE & FUNCTION
Concept article.
Why are drugs with a similar mode of action to the fatal nerve gas Sarin used to treat the symptoms of dementia ?
لماذا تُسْتَخْدَم أشباه مادة السّارين Sarin، وهو غاز الأعصاب الخطير والقاتل، في معالجة أعراض مرض الزهايمر وعِلل الشيخوخة ؟
RA
CHEDI Abdelkrim
Laboratory of Biotoxicology, Pharmacognosy and biological valorisation of plants, Faculty of
Natural and Life Sciences, Department of Biology, University of Saida - Dr Moulay Tahar, 20100 Said
a, Algeria.
Published: 01 October 2022
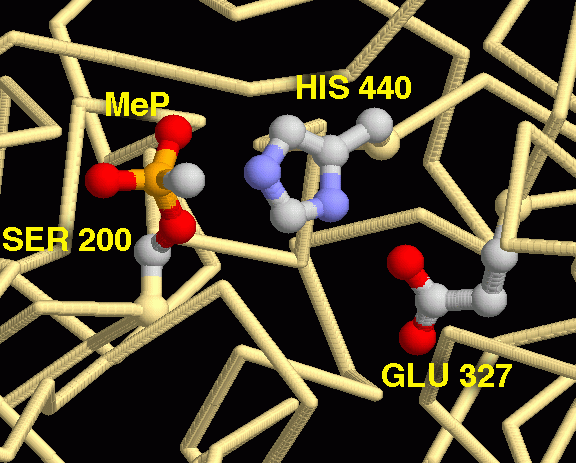
The toxin Sarin🔶 and derivatives have the potential to inhibit acetylcholinesterase, the AChE enzyme, by binding the triad active site S.E.H (Serine, Glutamine & Histidine). Sarin covalently adds a methylphosphonate group (MeP) to Serine thereby disabling AChE from carrying it's natural biofunction, see image 2.
In healthy people, intoxication with Sarin leads to accumulation of acetylcholin in muscles, as a results of inhibiting AChE enzyme, causing muscular paralysis and death.
However, for the Alzheimers patients, carefully guided 'toxication' /treatment by well estimated doses of Sarin & derivatives⭕ induces their neural system to produce more neurotransmitters which help strengthen neural signals in the still intact neurons and hence help patients recover their memory capacities step by step.
غاز الأعصاب السّارين🔶 Sarin و مشتقاته هي مركبات قادرة على تسميم أو تثبيط إنزيم الأسيتيلكولين إستراز acetylcholinesterase على مستوى الموقع الفعال ثلاثي الأحماض الفعالة S.E.H (السيرين S، الجلوتاميك E والهستيدين H) حيث يضيف السّارين Sarin مجموعة ميثيل_الفوسفونات MeP برابطة تساهمية قوية مع حمض السيرين S مانعا بذلك الإنزيم من القيام بفعله البيوكيميائي الطبيعي؛ أنظر صور ة 2 أدناه للموقع الفعال.
في حالة الأصحاء التسمم بالسّارين Sarin يعطل هذا الأنزيم ما يؤدي إلى تراكم الأسيتيلكولين acetylcholin مسببا الشلل العضلي والموت .. الخ
أما في حالة مرضى الزهايمر، فعملية التسميم بالسّارين ومشتقاته، أي التسميم العلاجي المدروس بعناية فائقة ⭕، لإنزيم الأسيتيلكولين إستراز acetylcholinesterase تعمل على حثِّ الجهاز العصبي على فرز المزيد من النواقل العصبية neurotransmitters والتي من شأنها تقوية الإشارات العصبية للعصبونات التي لا تزال باقية لدى دماغ مريض الزهايمر (حيث أن دماغ المريض يفقد الكثير من العصبونات والروابط العصبية ما يسبب فقدان الذاكرة .. الخ) مؤديا إلى مساعدة المريض على استرجاع ذاكرته شيئا فشيئا.
Refer to the following for more in the subject:
راجع مايلي للمزيد في الموضوع:
The usefulness of 3D-structure in this case is the deep knowledge at atomic resolution of the mechanism in action of the Sarin. Such level of understanding helps not only in better selection and rational design of new drugs against toxins but rather use their very mechanism against the toxicity and in effective treatment of such cases like Alzheimers.
الفائدة من التركيب الفراغي في هذه الحالة هي المعرفة العميقة وعالية الدقة، تماما على المستوى الذري، لكيفية عمل السموم العصبية مثل السّارين Sarin . هذا يساهم كذلك ليس فقط في إنتخاب وتصميم عقارات مناسبة تمنع فعل هذه السموم وإنما في استخدام أنظمة فعل السموم ضدها .. الأمر الذي مَكَّنَ في حركة أكثر عمقا من مجرد منع السّموم إلى استغلالها في الطب والتقليل من آثار أمراض خطيرة مثل الزهايمر.
The following links provide the web-service SSFS❇️ to help in exploding the structure/function relationship in some of AChE available structures in complex with important ligands:
في إطار دراسة علاقة الوظيفة بالتركيب الفراغي يمكن استكشاف تراكيب إنزيم الأسيتيلكولين إستراز على التطبيق ❇️SSFS:
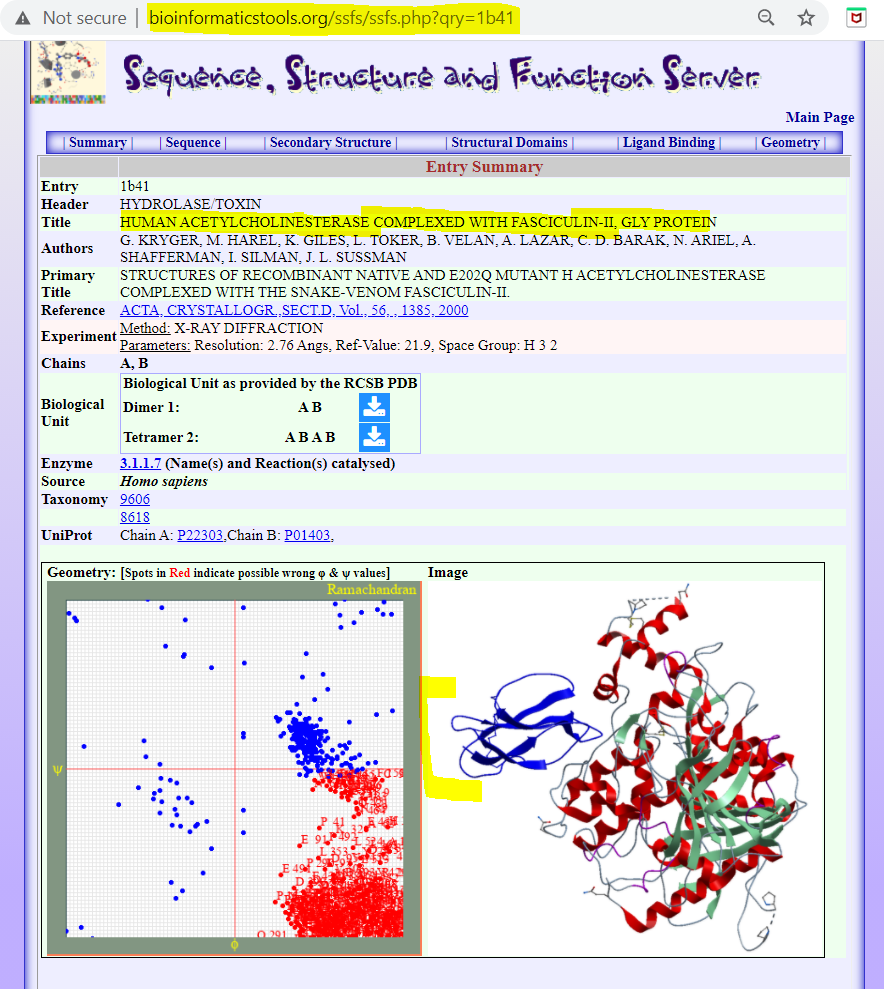
Human Acetylcholinesterase Complexed With Fasciculin-Ii, Gly Protein
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1b41 - see image 2
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1b41 - see image 2
Three Dimensional Structure Of The Anti-Alzheimer Drug, E202 (Aricept), Complexed With Its Target Acetylcholinesterase
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1eve - see image 3
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1eve - see image 3
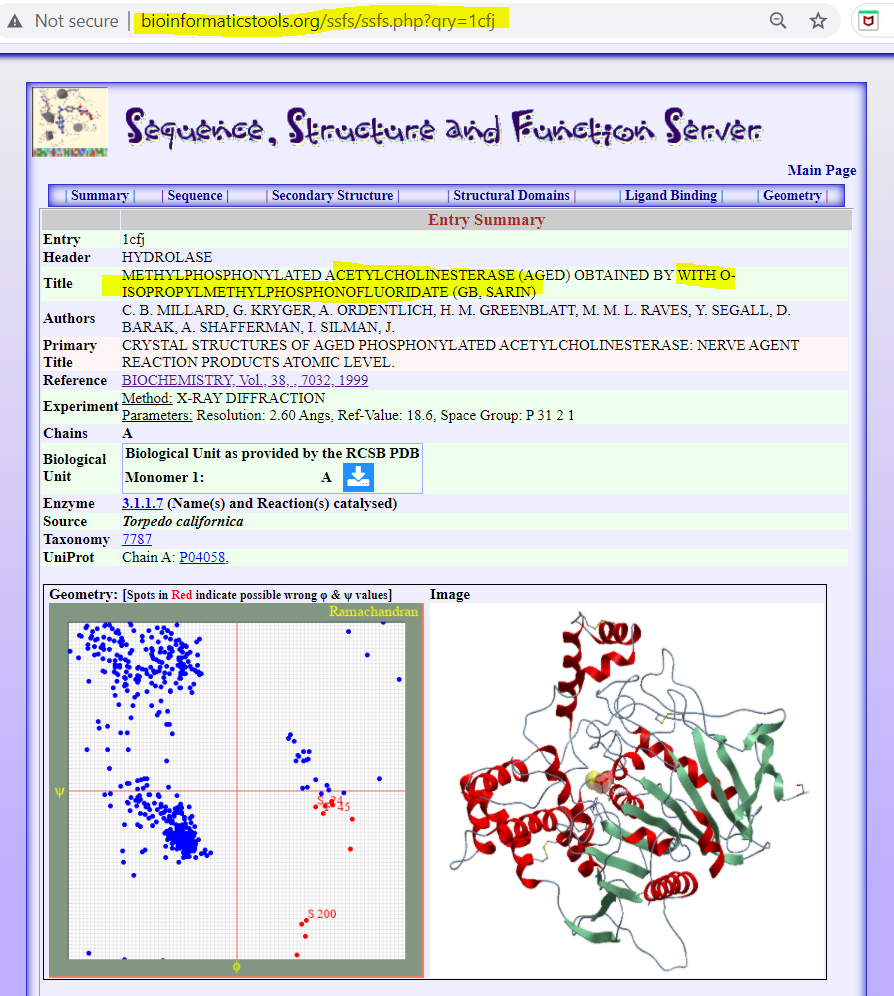
Methylphosphonylated Acetylcholinesterase (Aged) Obtained By With O-Isopropylmethylphosphonofluoridate (GB, SARIN)
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1cfj - see image 4
🖝 https://bioinformaticstools.org/ssfs/ssfs.php?qry=1cfj - see image 4
For finding integrated data related to Genomes, Proteomes, related Drugs, more 3D-structures and Scientific Literature and more, Neuro❇️ web-application can be used, the link:
من نواحي أخرى، يمكن استخدام التطبيق ❇️Neuro للحصول على بيانات علمية مدمجة في مجال سلاسل البروتيوم، الجينوم، و أدوية الزهايمر و جملة التراكيب الفراغية ذات العلاقة والمناشير العلمية، على الرابط التالي:
🖝 http://bioinformaticstools.org/neuro The Neuro - see image 5
Load the Neuro link, above, and search for the keyword 'Alzheimer' or use the following direct link:
قم بتحميل رابط Neuro أعلاه ، وابحث عن الكلمة المفتاح "Alzheimer" أو استخدم الرابط المباشر التالي:
🖝 https://bioinformaticstools.org/neuro/query_Nr.php?srch=Go..&query=Alzheimer - See image 6 and image 7
🔶 The nerve gas Sarin is about 26 times more lethal than Cyanide; See the link below:
غازالأعصاب السارين Sarin هو أشد فتكا وقتلا بحوالي 26 مرة مقارنة بغاز السانيدِ Cyanide؛ أنظر الرابط الموالي:
⭕ A dose of Sarin or its derivatives is sufficient to inhibit a specific percentage of the enzyme acetylcholinesterase and not the entire amount of the enzyme so that the harsh and fatal toxic effect is avoided.
جرعة السارين Sarin أو مشتقاته تكون كافية لتثبيط نسبة محددة من إنزيم الأسيتيلكولين إستراز acetylcholinesterase وليس كل كمية الإنزيم حيث يتم تفادي التأثير السمي العنيف والقاتل.
❇️Both 'SSFS' and 'Neuro' are online web-applications specialized in bioinformatics. They have been created by the Structural Biology and Bioinformatics Group, Department of Biology, Saida University, Algeria. These applications are published in research papers are referred to on their respective web pages; click on the link mentioned above.
كل من SSFS و Neuro هي تطبيقات متخصصة في المعلوماتية_الحيوية Bioinformatics متوافرة على الواب (الشبكة العنكبوتية) و هي من إنتاج فريق البيولوجيا_التركيبية و المعلوماتية_الحيوية Structural Biology and Bioinformatics Group، قسم البيولوجيا، جامعة سعيدة، الجزائر .. وهي تطبيقات لها مراجع منشورة في بحوث/أوراق علمية مُشار إليها في صفحة الواب لكل منها؛ أنقر على الراوابط المشار إليها أعلاه.
Refer also to the related articles, by this journal, at the links:
راجع المقالات ذات العلاقة بالموضوع، متوفرة على هذه المجلة، عبر الروابط التالية:
علاقة أمراض مثل الزهايمر و جنون البقر بالتَّشَكُّل الخاطئ في التركيب-الفراغي للبروتينات..
النظام، GABAagent، محرك-بحث خاص بـ مستقبلات GABA العصبية والجزيئات المنظمة و المزيد .. - جامعة سعيدة، الجزائر
🖍The research paper on GABAagent is published in Oxford Journals, specifically the specialized journal Bioinformatics:
ورقة البحث حول محرك-البحث GABAagent منشورة في إطار مجلات أكسفورد Oxford Journals و بالتحديد المجلة المتخصصة Bioinformatics:
🖝 Abdelkrim Rachedi et al., GABAagent: a system for integrating data on GABA receptors. Bioinformatics. 2000 Apr;16(4):301-12 - Reference research paper
For even more reading in the subject of Dementia and Alzheimer’s, refer to the following links:
لمزيد من القراءة في موضوع الخرف والزهايمر ، يرجى الرجوع إلى الروابط التالية: