JSBB: Volume 1, Issue 2, Spetember 2022 - STRUCTURE & FUNCTION ARTICLES,
Concept Article
Luciferase's Bio-natural Light; its 3D-Structure & Function
الضوء البيوـطبيعي لإنزيم اللّوسِفيراز؛ وظيفته وتركيبه الفراغي
Abdelkrim RACHEDI
The Luciferase enzyme exists in a large number of light emitting insects like the Firefly beetle where the enzyme uses ATP to oxidise the substrate Luciferin producing Oxyluciferin which, initially and momentarily, is highly "excited" or "energized" then quickly moves to the stable state by releasing a light photon responsible for the phenomena of Bio-natural light or Bioluminescence.
The mode of action of the Luciferase enzyme leads to the generation of light photons from luciferin, the substrate, in
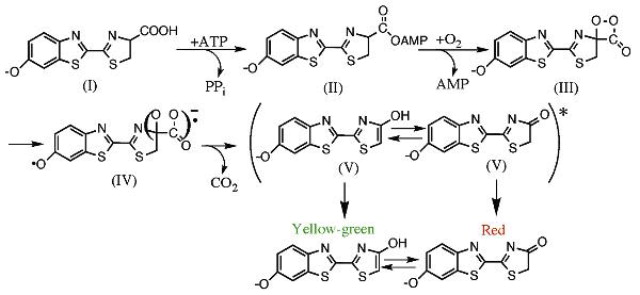
a process of multiple steps; first, the sustrate in the Dextro form, D-luciferin, is adenylated
by MgATP (ATP+Mg++) making luciferyl adenylate and pyrophosphate PPi. The luciferyl adenylate
is oxidized by molecular oxygen to form a dioxetanone ring after activation by ATP. Then a decarboxylation reaction forms an
excited state of oxyluciferin, that interconverts between the keto-enol form (tautomerization).
The reaction ends by emition of light, of maximum intensity (Imax) in the range of 562–570 nm, as oxyluciferin
has to return to the non-excited state. The biochemical reaction intermediated by the Luciferase enzyme is summerized below:
إنزيم، اللّوسِفيراز Luciferase، يتواجد في كثير من الحشرات المضيئة ليلا مثل اليراعة Firefly حيث يقوم هذا الإنزيم باستخدام الـ ATP لأكسدة مادة اللوسيفيرين Luciferin منتجا لمركب الأوكسي-لوسيفيرين Oxyluciferin الذي يكون لحظة تكونه في حالة "منفعلة أو متهيجة" يتحرر على إثرها فوتون ضوئي ليتحول المركب أخيرا إلى الحالة المستقرة.
تؤدي طريقة عمل إنزيم Luciferase إلى توليد فوتونات ضوئية من luciferin ، الرّكيزة أومادة التفاعل، في
تفاعل من عدة خطوات. أولاً ، تكون الرّكيزة في تركيب يميني التوجه dextro ، أو D-luciferin ، حيث يتم إضافة جذر أدلين
لها adenylation
بواسطة ATP في وجود المغنيسيوم Mg (MgATP أو Mg++ + ATP) مما ينتج أدينيلات لوسيفريل luciferyl adenylate و جزئ بيروفوسفات pyrophosphate PP i .
يتأكسد أدينيلات لوسيفريل
بواسطة الأكسجين الجزيئي لتشكيل حلقة ثنائي الإكسِتانون بعد التنشيط بواسطة ATP. في المرحلة الثانية يتولى تفاعل نزع الكربوكسيل و يؤدي إلى تشكيل
ـ أوكسيلوسيفيرين في حالة مُثارة، يتم فيه تحول_تمايزي (tautomerization) بين تراكيب كيتو-إنول
.
ينتهي التفاعل بانبعاث الضوء ، بأقصى شدة ضوئية (Imax) تقع في المجال الطيفي 562-570 نانومتر ،
حيث أن الأوكسيلوسيفيرين
يجب أن يعود إلى حالة الإستقرار
.
التفاعل الكيمياء_الحيوي الذي يقوم به إنزيم لوسيفيراز يمكن تلخيصه فيما يلي:
🖝 D-luciferin + ATP → Luciferyl adenylate + PPi
🖝 Luciferyl adenylate + O2 → Oxyluciferin + AMP + 💡
- see also image 2
This bio-reaction occurs millions of times inside special cells producing the beautiful light of the beetles.
يحدث هذا التفاعل ملايين المرات في خلايا خلصة منتجا الضوء الجميل لليراعات.
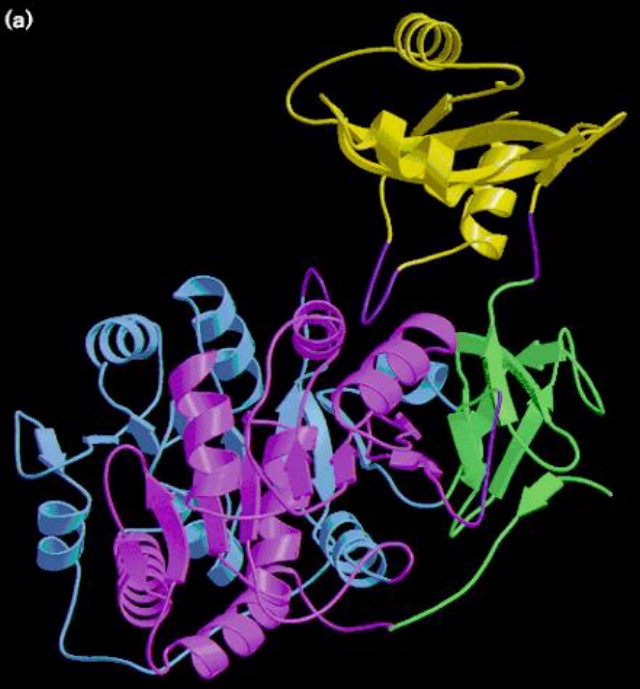
The firefly luciferase structure is mainly composed of two domains; an N-terminal domain and a
C-terminal domain.
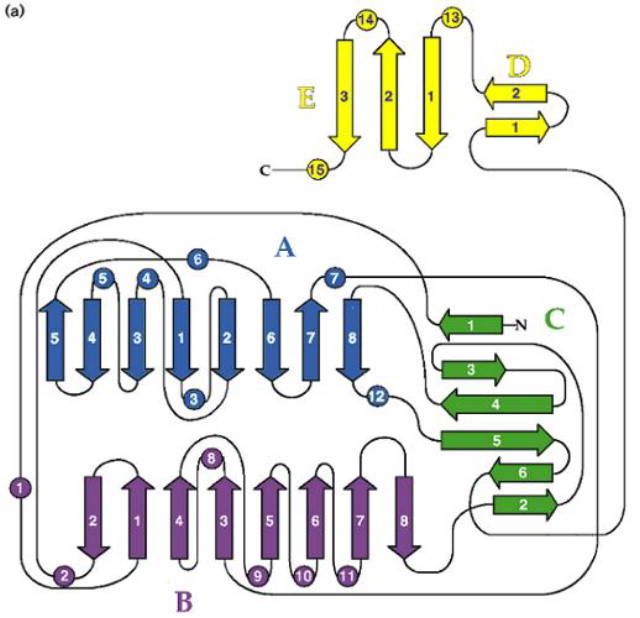
The N-terminal domain is made up of two β-sheets configured in a structural αβαβα motif and a β-barrel. The blobe of the two β-sheets's end is covered with
the β-barrel. The C-terminus of the enzyme forms a small separate α+β domain. - see image 3
A structurally flexible hinge links the C-terminal domain with the N-terminal domain thereby separating the two domains. The residues (amino acids) int he surfaces facing each other in the two domains are conserved in bacterial and firefly luciferases. That can infere that the active site is located in the region between the two domains. - see also image 4
The structural studies lead to the understanding that during a reaction, the Luciferase undergoes a conformational change into a closed form in which the two domains come together to envlope the substrate. This is rationalized to serve exclude water from the reaction and prevent hydrolyzing ATP or electronically excite products.
A structurally flexible hinge links the C-terminal domain with the N-terminal domain thereby separating the two domains. The residues (amino acids) int he surfaces facing each other in the two domains are conserved in bacterial and firefly luciferases. That can infere that the active site is located in the region between the two domains. - see also image 4
The structural studies lead to the understanding that during a reaction, the Luciferase undergoes a conformational change into a closed form in which the two domains come together to envlope the substrate. This is rationalized to serve exclude water from the reaction and prevent hydrolyzing ATP or electronically excite products.
يتكون هيكل إنزيم لوسيفيرازاليراعة بشكل أساسي من نطاقين ؛ نطاق النّهاية_الأمينية N-terminal domain و نطاق النّهاية_الكربوكسلية C-terminal domain.
يتكون نطاق النّهاية_الأمينية من وَرَقَتَيْ_β (أو β-sheets) منتظمتين في شكل هيكلي (motif) αβαβα وبرميل_β (أو β-barrel) . يقوم هذا الأخير بتغطية خلفية الورقتين_β. النّهاية_الكربوكسلية للإنزيم عبارة عن نطاق صغير في تشكلα+β
(α+β domain) - أنظر الصورة 3
. يرتبط النطاقان النّهاية_الأمينية و الكربوكسيلية معا برابط مرن (flexible hinge) يفصل النطاقين. الأحماض الأمينية البارزة، على سطحي وَرَقَتَيْ_β، و المواجه لبعضها البعض في النطاقين محفوظة conserved في إنزيم اللّوسيفيراز في كل من البكتيرية و اليراعة. و هذا ما يؤضر إلى أن الموقع الفعال active site يقع في المنطقة الواقعة بين النطاقين. - راجع أيضًا الصورة 4
الدّراسات التركيبية أدت إلى الإستنتاج أنه أثناء التفاعل ، يخضع إنزيم اللّوسيفيرازلتغير هيكلي في هيئة مغلقة ما يُجبر النطاقات إلى التقارب و التجمع لتطويق الركيزة substrate. يُعتقد أن هذا التغير الهيكلي ضروري لإستبعاد جزيئات الماء من التفاعل ومنع التحلل المائي لـِ ATP أو الإستثارة الإلكترونية لنواتج التفاعل.
. يرتبط النطاقان النّهاية_الأمينية و الكربوكسيلية معا برابط مرن (flexible hinge) يفصل النطاقين. الأحماض الأمينية البارزة، على سطحي وَرَقَتَيْ_β، و المواجه لبعضها البعض في النطاقين محفوظة conserved في إنزيم اللّوسيفيراز في كل من البكتيرية و اليراعة. و هذا ما يؤضر إلى أن الموقع الفعال active site يقع في المنطقة الواقعة بين النطاقين. - راجع أيضًا الصورة 4
الدّراسات التركيبية أدت إلى الإستنتاج أنه أثناء التفاعل ، يخضع إنزيم اللّوسيفيرازلتغير هيكلي في هيئة مغلقة ما يُجبر النطاقات إلى التقارب و التجمع لتطويق الركيزة substrate. يُعتقد أن هذا التغير الهيكلي ضروري لإستبعاد جزيئات الماء من التفاعل ومنع التحلل المائي لـِ ATP أو الإستثارة الإلكترونية لنواتج التفاعل.
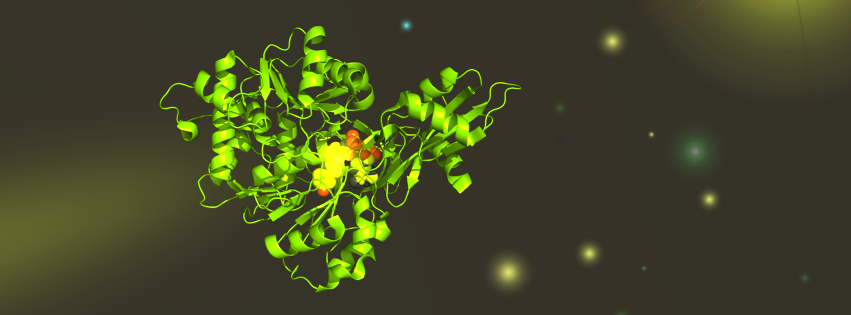
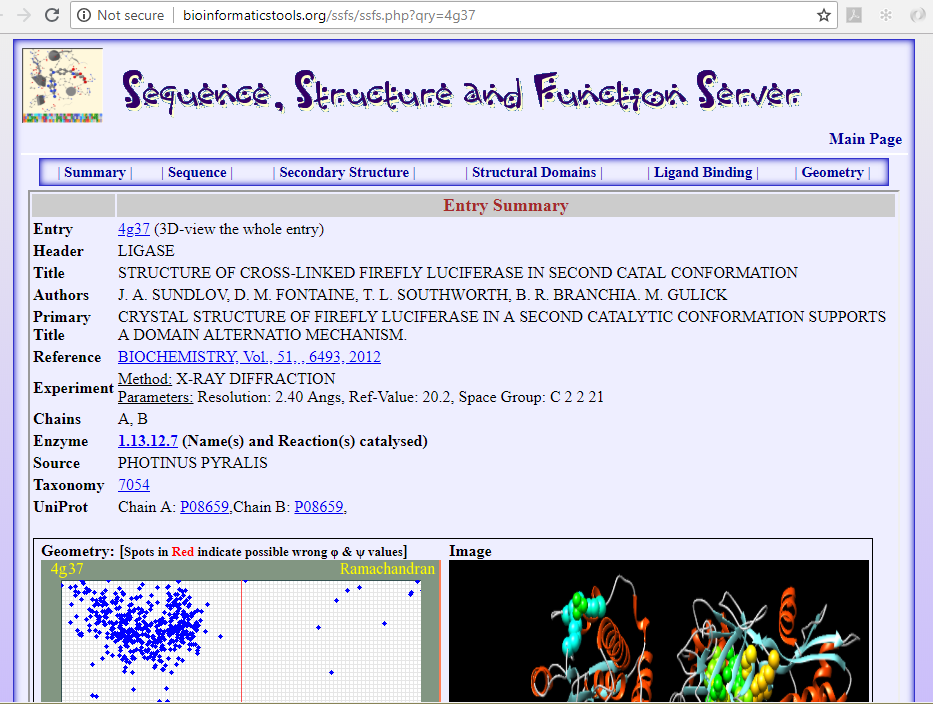
It's possible to explore the 3D-structure of one of available structures of the Luciferase enzyme, from the species Photinus pyralis and its function using the SSFS❇️ application from the BioinformaticsTools web-site, Department of Biology, Faculty of Science, University of Saida, Algeria, through the URL link:
يمكن استكشاف التركيب الفراغي وكذلك الوظيفة المُنْتِجَة للضوء لأحد التراكيب المتوافرة لإنزيم اللّوسِفيراز مستخلصة من الحشرة من نوع Photinus pyralis باسخدام التطبيق SSFS❇️ من موقع المعلوماتية_الحيوية لجامعة سعيدة، قسم البيولوحيا من الموقع التالي:
🖝 Crystal Structure of Firefly Luciferase in a Second Catalytic Conformation Supports a Domain Alternation Mechanism.
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=4g37 - images 5 & 6
https://bioinformatics.univ-saida.dz/ssfs/ssfs.php?qry=4g37 - images 5 & 6
For even more reading in the subject, refer to the following links:
للمزيد حول هذا الموضوع وما يرتبط به من تفاصيل أنظر الروابط التالية:
🖝 Firefly luciferase: the structure is known, but the mystery remains - Review paper
🖝 Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes - Research paper
🖝 Firefly_luciferase - Wikipedia article
❇️ SSFS: Sequence, Structure and Function Server by the Structural Biology & Bioinformatics Groups, Biology Dept, Faculty of Science, University of Saida, Algeria
نظام: سلسلة التركيب الأولي، التركيب الفراغي و الوظيفة البيولوجية ، فريق البيولوجيا ثلاثية
الأبعاد و المعلوماتية الحيوية، قسم البيولوجيا، كلية العلوم، جامعة سعيدة، الجزائر